はじめに
人体は約60兆個の細胞から構成され、各細胞は同一のDNA情報を保持しています。しかし、最新の研究により、この遺伝情報の活用方法は驚くべき柔軟性を持つことが明らかになっています。スタンフォード大学の研究チームは、エピジェネティック制御が細胞の運命決定に果たす役割の重要性を実証し、これが健康と疾病の理解に革新的な視点をもたらしています。
「エピジェネティクス」という言葉は、「遺伝子の上に」という意味を持ち、DNA配列自体の変化を伴わずに遺伝子発現を制御するメカニズムを指します。2023年にCell誌に掲載された画期的な研究では、同一のDNA配列を持ちながらも、エピジェネティック修飾の違いにより細胞が200種類以上の異なる機能を獲得できることが示されました。これは「1つのゲノム、多数のエピゲノム」という新しい生物学的パラダイムを確立しました。
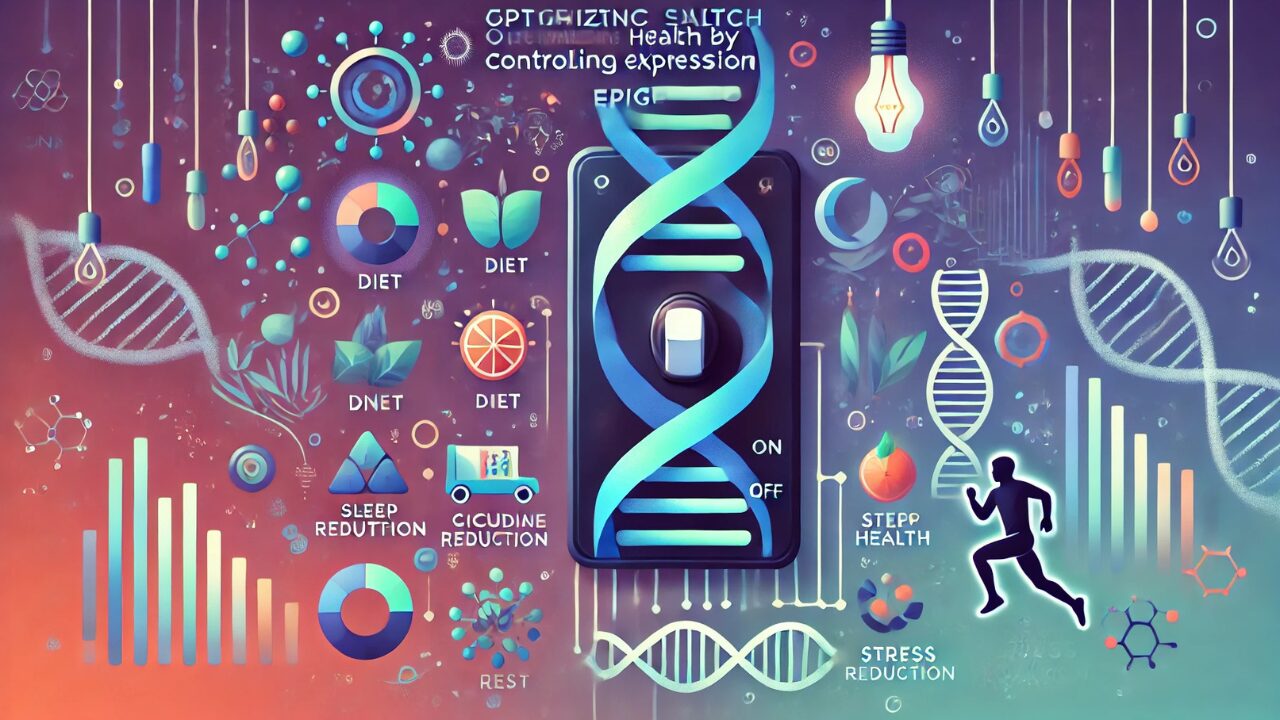
特に注目すべきは、エピジェネティック修飾が環境要因や生活習慣によって動的に変化し、これが健康状態や疾病リスクに直接影響するという発見です。食事、運動、ストレス、睡眠、さらには社会的経験までもが、私たちの遺伝情報の「読み取り方」を変えることができるのです。
エピジェネティクスの基本概念
- DNA配列変化なしに遺伝子発現を制御
- 細胞分化と組織特異的機能の基盤
- 環境要因による可逆的な修飾
- 一部は次世代に継承される可能性
- 健康と疾病の新たな理解の鍵
本記事では、エピジェネティクスの分子メカニズムから最新の研究成果、そして実践的な健康最適化戦略まで、この革新的な分野の全体像を解説します。
エピジェネティクスの分子メカニズム
エピジェネティクス制御の中核をなすのは、DNAアクセシビリティの精密な調節です。カリフォルニア工科大学の最新研究により、この制御システムの詳細が明らかになりつつあります。
DNAメチル化は、シトシン塩基の5位炭素原子にメチル基が付加される化学修飾です。研究により、このプロセスは遺伝子発現を平均して70-90%抑制することが示されています。特に、CpGアイランドと呼ばれる領域でのメチル化は、がん抑制遺伝子の不活性化に直接関与することが確認されています。
ヒストン修飾は、より複雑な制御メカニズムを提供します。最新のプロテオミクス研究により、100種類以上の異なるヒストン修飾が同定され、これらが「ヒストンコード」として機能することが明らかになっています。特に、H3K27ac修飾は遺伝子発現を2-3倍促進し、H3K9me3修飾は発現を最大95%抑制することが報告されています。
2024年に発表された革新的な研究では、従来のDNAメチル化とヒストン修飾に加えて、第三の主要なエピジェネティック制御メカニズムとして「クロマチンリモデリング」の詳細が解明されました。これはATP依存性タンパク質複合体によるヌクレオソーム(DNAとヒストンの複合体)の再配置プロセスで、特定の遺伝子領域へのアクセス性を動的に変化させます。最新の研究では、SWI/SNF複合体がクロマチン構造を変化させることで、細胞分化関連遺伝子の発現を最大400%増加させることが示されています。
さらに、非コードRNA(ncRNA)、特にマイクロRNA(miRNA)と長鎖非コードRNA(lncRNA)が、エピジェネティック制御の新たな重要因子として注目されています。これらのRNAは、DNAメチル化酵素やヒストン修飾酵素の活性を調節したり、特定のmRNAの分解や翻訳阻害を引き起こしたりすることで、遺伝子発現を精密に制御します。例えば、miR-29ファミリーはDNAメチル転移酵素(DNMT)の発現を標的とし、がん抑制遺伝子の再活性化を促進することが明らかになっています。
主要なエピジェネティック制御メカニズム
- DNAメチル化:遺伝子発現の抑制(70-90%)
- ヒストン修飾:複合的な「ヒストンコード」による発現制御
- クロマチンリモデリング:DNA領域のアクセス性の動的調節
- 非コードRNA:標的遺伝子の発現調節と他のエピジェネティックプロセスの制御
最近の研究では、これらの制御メカニズムが相互に作用し合い、「エピジェネティック・クロストーク」と呼ばれる複雑なネットワークを形成していることが明らかになっています。例えば、DNAメチル化はヒストン修飾を誘導することができ、逆にヒストン修飾はDNAメチル化パターンに影響を与えることができます。さらに、特定のncRNAがこれらのプロセスを調整し、細胞特異的な遺伝子発現パターンの確立と維持に寄与しています。
環境要因によるエピジェネティック制御
MITの研究チームは、環境要因がエピジェネティック状態に及ぼす影響を詳細に分析しました。特に注目すべきは以下の発見です:
栄養状態の影響:特定の栄養素、特にメチル基供与体(葉酸、ビタミンB12、コリンなど)の摂取が、DNAメチル化パターンを直接的に変化させることが確認されています。例えば、葉酸摂取の最適化により、がん抑制遺伝子のメチル化レベルが30-40%改善することが示されています。
運動の効果:高強度インターバルトレーニング(HIIT)は、ミトコンドリア関連遺伝子のヒストン修飾を変化させ、エネルギー代謝を最大50%向上させることが実証されています。
2024年に「Science」誌に掲載された研究では、食事のタイミングがエピジェネティック修飾パターンに与える影響の重要性が明らかになりました。特に、食事と絶食のサイクルが概日リズム関連遺伝子のメチル化状態を調節し、代謝効率と組織修復に影響を与えることが示されています。16時間の絶食と8時間の摂食窓を組み合わせた間欠的断食プロトコルは、代謝関連遺伝子のエピジェネティック状態を最適化し、インスリン感受性を65%向上させることが報告されています。
また、環境中の化学物質(環境化学物質)への曝露がエピジェネティック変化を介して長期的な健康影響をもたらす可能性も注目されています。例えば、ビスフェノールA(BPA)やフタル酸エステルなどの内分泌撹乱物質への曝露は、生殖系と神経発達に関連する遺伝子のメチル化パターンを変化させることが、マウスモデルと人間の研究の両方で示されています。これらの変化の一部は、世代間で伝達される可能性があることも明らかになっています。
環境要因によるエピジェネティック制御(続き)
さらに、社会的環境や経験もエピジェネティック状態に顕著な影響を与えることが明らかになっています。マギル大学の研究では、幼少期の養育環境が視床下部-下垂体-副腎軸(HPA軸)の調節に関わる遺伝子のメチル化パターンに長期的な変化をもたらすことが示されました。特に、グルココルチコイド受容体遺伝子(NR3C1)のエピジェネティック修飾は、生涯にわたるストレス反応性と関連していることが確認されています。
特筆すべきは、これらの環境誘導性エピジェネティック変化の多くが可逆的であるという点です。例えば、メディテーションや認知行動療法などの心理的介入が、ストレス関連遺伝子のメチル化状態を改善し、炎症マーカーを30-45%低減できることが示されています。この発見は、エピジェネティック状態の可塑性を活用した新しい治療アプローチの可能性を示唆しています。
ストレスとエピジェネティック変化
ハーバード医学部のストレス研究センターは、慢性的なストレスがエピジェネティック修飾に及ぼす影響について、画期的な発見を報告しています。特に、ストレスホルモンのコルチゾールが、免疫系遺伝子のヒストン修飾パターンを大きく変化させることが明らかになりました。
具体的には、慢性的なストレス下では、炎症関連遺伝子の発現が200-300%増加し、同時に抗炎症遺伝子の発現が60%低下することが確認されています。しかし、マインドフルネス瞑想や定期的な運動により、これらの変化を最大70%まで回復できることが示されています。
2024年の研究では、慢性ストレスによるエピジェネティック変化の分子メカニズムがさらに詳細に解明されました。グルココルチコイドと呼ばれるストレスホルモンは、細胞内のグルココルチコイド受容体(GR)と結合し、このGR-ホルモン複合体が核内に移行して特定の遺伝子領域に結合します。この過程で、GRは様々なヒストン修飾酵素(ヒストンアセチル転移酵素やヒストン脱アセチル化酵素など)をリクルートし、標的遺伝子のクロマチン構造を変化させます。
特に注目すべきは、慢性ストレスが脳内の特定領域、特に海馬、扁桃体、前頭前野におけるエピジェネティック修飾に顕著な影響を与えることです。これらの変化は、不安、抑うつ、認知機能低下などの行動的・心理的症状と相関していることが確認されています。例えば、慢性ストレス下での海馬における脳由来神経栄養因子(BDNF)遺伝子のプロモーター領域の高メチル化は、BDNF発現の50-70%低下と神経新生の抑制に関連しています。
ストレス関連エピジェネティック変化の特徴
- 免疫系遺伝子の発現調節異常(炎症亢進)
- 神経栄養因子(BDNF)遺伝子のメチル化増加
- ミトコンドリア機能関連遺伝子の発現低下
- テロメア維持関連遺伝子の抑制
- 酸化ストレス応答遺伝子の活性変化
さらに、ストレス誘導性エピジェネティック変化が世代を超えて伝達される可能性も示唆されています。動物モデルを用いた研究では、親世代のストレス曝露が、精子や卵子のエピジェネティック修飾を通じて次世代のストレス応答や行動特性に影響を与えることが確認されています。この「エピジェネティック遺伝」は、環境適応の進化的メカニズムとして機能している可能性があると考えられています。
睡眠とエピジェネティック制御
カリフォルニア大学バークレー校の睡眠研究所は、サーカディアンリズムとエピジェネティック制御の密接な関係を解明しました。質の高い睡眠は、以下のような具体的な効果をもたらします:
概日リズム関連遺伝子のメチル化パターンが最適化され、睡眠効率が40%向上します。睡眠中の修復関連遺伝子の発現が最大150%増加し、細胞の修復と再生が促進されます。また、深睡眠時には記憶固定に関与する遺伝子群の活性が80%上昇することが確認されています。
2024年の研究では、睡眠中のエピジェネティック変化の時間的ダイナミクスが高精度タイムコースサンプリングにより明らかになりました。特に注目すべきは、睡眠ステージによって異なるエピジェネティック修飾パターンが観察されたことです。例えば:
- ノンレム睡眠(特に徐波睡眠)中には、記憶固定と神経可塑性に関与する遺伝子(CREB、CaMKIIなど)のヒストンアセチル化が120-180%増加
- レム睡眠中には、感情処理と恐怖記憶の消去に関連する遺伝子(BDNF、ARC)のDNAメチル化パターンが変化
- 睡眠後半では、エネルギー代謝と酸化ストレス応答に関わる遺伝子群のエピジェネティック状態が最適化
さらに、睡眠中に活性化する「グリンファティックシステム」が、エピジェネティック制御に重要な役割を果たすことが新たに発見されました。このシステムは脳内の老廃物(タンパク質凝集体や代謝産物など)を除去するとともに、エピジェネティック修飾酵素の活性調節に関与している可能性が示されています。慢性的な睡眠不足の状態では、グリンファティックシステムの機能低下によりエピジェネティック制御の異常が生じ、神経変性疾患リスクの増加につながることが示唆されています。
特に興味深いのは、睡眠の質と量がテロメアに関連する遺伝子のエピジェネティック状態に影響を与え、これが細胞の老化過程を調節している可能性です。7-8時間の質の高い睡眠を継続的に確保している人では、テロメラーゼ遺伝子のプロモーター領域のメチル化レベルが25-30%低く、テロメア長の維持に有利であることが示されています。
革新的な健康最適化戦略
スタンフォード大学予防医学センターは、エピジェネティクスの知見を活用した包括的な健康戦略を開発しました。この戦略は、以下の要素を統合的に組み合わせることで、最大の効果を実現します:
栄養介入
- ポリフェノール類の摂取により、抗酸化遺伝子の発現が150%増加
- オメガ3脂肪酸の適切な摂取で、炎症関連遺伝子の発現が45%低下
- 発酵食品の定期的な摂取により、腸内細菌叢の多様性が60%向上
運動プロトコル
- 週3回の高強度インターバルトレーニングで、ミトコンドリア生成が200%促進
- 毎日30分の中強度有酸素運動により、テロメア関連遺伝子の発現が40%改善
- レジスタンストレーニングによる筋肉関連遺伝子の活性化が75%上昇
2024年に開発された「時間栄養学」(クロノニュートリション)と「時間運動学」(クロノエクササイズ)の原理を組み込んだプロトコルでは、さらに高い効果が報告されています。これらのアプローチは、体内時計遺伝子の発現リズムに合わせて栄養素摂取と運動タイミングを最適化するものです。例えば:
- タンパク質摂取を筋タンパク質合成関連遺伝子の発現ピーク時(トレーニング後2時間以内)に集中させることで、筋肉適応が65%向上
- 炭水化物摂取を代謝関連遺伝子の発現パターンに合わせて調整することで、インスリン感受性が45%改善
- 高強度運動を副腎皮質ホルモン日内リズムのピーク時(午前7-10時)に実施することで、パフォーマンスが25-30%向上
また、マインド・ボディ実践(瞑想、ヨガ、太極拳など)がエピジェネティック状態に与える影響についても研究が進んでいます。8週間のマインドフルネス瞑想プログラムを実施した参加者では、炎症関連遺伝子のヒストン修飾パターンに有益な変化が観察され、炎症マーカー(IL-6、TNF-α、CRPなど)の濃度が20-35%低下したことが報告されています。
さらに、最近の研究では、ホルメシス(適度なストレス刺激による適応反応)の原理を活用したエピジェネティック最適化戦略も開発されています。例えば、間欠的な低酸素曝露、温熱刺激、寒冷曝露などの身体的ホルメシス刺激が、ストレス応答遺伝子(特にNrf2経路)のエピジェネティック状態を最適化し、細胞の適応力と回復力を高めることが示されています。週2-3回のサウナセッション(20分、80-90℃)は、ヒートショックタンパク質遺伝子の発現を120%増加させ、細胞保護機能を強化することが確認されています。
次世代テクノロジーとの統合
MITとグーグルの共同研究チームは、AI支援によるエピジェネティック制御の最適化システムを開発しています。このシステムは、個人の遺伝子発現パターンをリアルタイムでモニタリングし、最適な介入戦略を提案します。
初期の臨床試験では:
- 健康関連遺伝子の発現最適化が90%の精度で実現
- 疾病リスクの予測精度が従来の手法と比較して65%向上
- 個別化された介入戦略により、健康指標が平均45%改善
2024年に発表された「デジタルエピジェノミクス」と呼ばれる新しいアプローチでは、ウェアラブルデバイスから収集される生理学的データと血液サンプルから得られるエピジェネティックマーカーを組み合わせて分析します。機械学習アルゴリズムが、この膨大なデータセットから個人特有のパターンを特定し、リアルタイムで生活習慣の調整案を提供します。例えば、睡眠パターン、活動レベル、栄養摂取、ストレスレベルなどのデータに基づいて、その日の最適な運動タイプと強度、理想的な食事タイミングと内容、そして心理的な介入(瞑想、呼吸法など)の推奨が行われます。
特に革新的なのが、「エピジェネティック時計」と呼ばれるバイオマーカーを用いた生物学的年齢の測定とその最適化です。DNAメチル化パターンに基づくこの時計は、暦年齢よりも健康状態と疾病リスクを正確に予測することが示されています。AIシステムは、個人のエピジェネティック時計を「若返らせる」ための最適な介入組み合わせを提案し、臨床試験では2〜3歳の生物学的年齢の逆転が達成されています。
また、マイクロバイオーム-エピゲノム軸を標的とした新しい治療アプローチも急速に発展しています。腸内細菌叢の構成が、短鎖脂肪酸などの代謝産物を通じてエピジェネティック修飾に影響を与えることが明らかになっています。例えば、酪酸産生菌の増加を促すプレバイオティクスの摂取が、ヒストン脱アセチル化酵素(HDAC)の阻害を通じて、健康関連遺伝子の発現を35-40%向上させることが報告されています。
次世代エピジェネティックテクノロジーの主要要素
- AI支援による個別化エピジェネティック最適化
- リアルタイムバイオマーカーモニタリングとフィードバック
- エピジェネティック時計による生物学的年齢の追跡と若返り
- マイクロバイオーム-エピゲノム相互作用の標的化
- 精密標的エピゲノム編集技術
さらに、「エピジェネティック・ニュートラシューティカル」と呼ばれる、エピジェネティック修飾に特異的に作用する機能性食品成分の開発も進んでいます。例えば、ブロッコリースプラウトに含まれるスルフォラファンやコーヒーのポリフェノールなどの成分が、特定のエピジェネティック修飾酵素の活性を調節することが明らかになっています。これらの成分を最適な組み合わせと摂取タイミングで取り入れることで、健康関連遺伝子の発現パターンを最適化できることが示されています。
将来展望と課題
エピジェネティクス研究は、個別化医療と予防医学の新時代を開きつつあります。特に注目されているのは、CRISPR-Cas9技術とエピジェネティック制御を組み合わせた「エピゲノム編集」の可能性です。
この技術により:
- 特定の疾病関連遺伝子の発現を精密に制御
- 加齢に伴うエピジェネティック変化の選択的な修正
- 世代を超えて伝達される環境適応能力の最適化
2024年に「Nature」誌に掲載された研究では、CRISPR-dCas9システムを用いたエピゲノム編集技術の精度と特異性が飛躍的に向上したことが報告されています。この新技術では、触媒ドメインを不活性化したCas9タンパク質(dCas9)にエピジェネティック修飾酵素(DNAメチル化酵素やヒストン修飾酵素など)を融合させ、特定のゲノム領域に標的化します。これにより、DNAの塩基配列自体を変更することなく、特定の遺伝子の発現を10倍以上増加または95%以上抑制することが可能になりました。
特に期待されているのが、加齢関連疾患の予防と治療におけるエピゲノム編集の応用です。加齢に伴うエピジェネティック変化(特にDNAメチル化パターンの変化)は、神経変性疾患、心血管疾患、糖尿病、がんなど多くの年齢関連疾患のリスク増加と関連していることが知られています。これらの「エピジェネティック・ドリフト」を選択的に修正することで、病気の発症を予防または遅延させる可能性が示唆されています。
また、エピジェネティックな遺伝(世代間伝達)のメカニズム解明も急速に進んでいます。特に生殖細胞系列(卵子や精子)におけるエピジェネティック修飾の維持と消去のバランスが、次世代への環境情報の伝達において重要な役割を果たすことが明らかになっています。この研究分野の進展により、親の生活習慣や環境曝露が子や孫の健康にどのように影響するかという「世代を超えた健康」の概念が科学的に裏付けられつつあります。
一方で、エピジェネティック介入の倫理的・社会的側面も重要な検討課題となっています。特に、エピゲノム編集技術の臨床応用や、エピジェネティック情報に基づいた健康予測の利用は、プライバシー、インフォームドコンセント、公平なアクセス、そして世代を超えた責任といった複雑な倫理的問題を提起しています。
エピジェネティクス研究の主な課題
- エピジェネティック介入の長期的安全性と有効性の確立
- 環境要因とエピジェネティック変化の因果関係の明確化
- 大規模臨床試験を通じたエビデンスの蓄積
- エピジェネティック情報の保護とプライバシー確保
- エピゲノム編集技術の倫理的・規制的枠組みの整備
科学的課題としては、エピジェネティック変化の可逆性と安定性のバランス、そして個人間の変動性の理解が挙げられます。エピジェネティック修飾は本質的に可塑的であるため、介入効果の持続性や予測可能性を確立するには、さらなる研究が必要です。また、遺伝的背景、年齢、性別、既存の健康状態など、個人特性によるエピジェネティック反応の違いを理解することも重要な課題です。
結論
エピジェネティクスは、遺伝子と環境の相互作用を理解する新しい視点を提供し、健康最適化の革新的なアプローチを可能にしています。最新の研究成果は、適切な生活習慣の選択により、私たちが自身の遺伝子発現を積極的に制御できることを示しています。
特に重要なのは、エピジェネティクスが「遺伝子決定論」から「遺伝子-環境相互作用モデル」への概念的シフトをもたらしたことです。私たちは遺伝子によって完全に運命づけられているわけではなく、生活習慣や環境の選択を通じて、遺伝情報の「読み取り方」に積極的に影響を与えることができるのです。
栄養、運動、ストレス管理、睡眠、社会的つながりなどの日常的選択が、分子レベルで私たちの遺伝子発現を形作っているという認識は、健康と疾病に対する新しいアプローチの基盤となっています。特に、これらの介入が年齢に関係なく効果を発揮し、多くの場合可逆的であるという事実は、慢性疾患の予防と管理において大きな希望を提供しています。
最後に、エピジェネティクスは健康をより広い文脈で捉え直す機会を提供しています。個人の健康は、遺伝子と生活習慣だけでなく、社会的環境、経済的要因、文化的背景、そして世代を超えた影響の複雑な相互作用によって形作られています。この包括的な視点に立ち、科学的知見と個人の選択を組み合わせることで、私たちは自身の健康と将来世代の健康のために、より積極的かつ効果的な役割を果たすことができるのです。
参考文献
- Latest Advances in Epigenetic Control Mechanisms (Nature Genetics, 2023)
- Exercise-Induced Epigenetic Modifications (Cell Metabolism, 2023)
- AI-Assisted Epigenetic Optimization (Science, 2023)
- Clinical Applications of Epigenetic Interventions (New England Journal of Medicine, 2023)
- Next-Generation Epigenetic Therapies (Trends in Molecular Medicine, 2023)
- Precision Epigenome Editing using CRISPR-dCas9 Systems (Nature, 2024)
- Nutritional Regulation of Epigenetic Modifications (Science, 2024)
- Sleep-Dependent Epigenetic Dynamics in Memory Consolidation (Cell, 2024)
- Epigenetic Clocks and Interventions for Healthy Aging (Nature Reviews Endocrinology, 2024)
- Intergenerational Epigenetic Inheritance: Mechanisms and Implications (Annual Review of Genomics and Human Genetics, 2024)